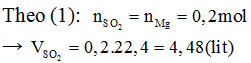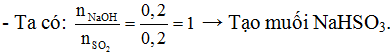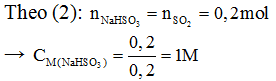Đề kiểm tra 1 tiết Hóa 10 Chương 6 - Đề 10
Đề kiểm tra 1 tiết Hóa 10 Chương 6 - Đề 10
ĐỀ BÀI
I. PHẦN TRẮC NGHIỆM (20 câu, 5đ)
Câu 1: Để pha loãng axit sunfuric đặc ta làm như thế nào?
A. Rót từ từ axit vào nước và dùng đũa thủy tinh khuấy nhẹ
B. Rót từ từ nước vào axit và dùng đũa thủy tinh khuấy nhẹ
C. Đổ đồng thời axit và nước vào cốc và dùng đũa thủy tinh khuấy nhẹ
D. Đổ axit đặc vào axit loãng rồi pha thêm nước.
Câu 2: Trong các phản ứng sau, chọn phản ứng trong đó H2S có tính axit
A. 2H2S + O2 → 2S + 2H2O
B. H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
C. 2FeCl3 + H2S → 2FeCl2 + S + 2HCl
D. 2H2S + 2K → 2KHS + H2
Câu 3: H2SO4 loãng có thể tác dụng với tất cả các chất thuộc nào dưới đây?
A. Fe3O4, BaCl2, NaCl, Al, Cu(OH)2.
B. Fe(OH)2, Na2CO3, Fe, CuCl2, NH3.
C. Zn(OH)2, CaCO3, CuO, Al, Fe2O3.
D. CaCO3, Cu, Al(OH)3, MgO, Zn.
Câu 4: Câu nào sai khi nhận định về tính chất hóa học của dung dịch axit sunfuric loãng:
A. Tác dụng với kim loại đứng trước hidro
B. Có tính axit mạnh
C. Tác dụng với nhiều phi kim
D. Tác dụng oxit bazơ tạo muối axit hoặc muối trung hòa.
Câu 5: Tính chất hóa học của dung dịch axit sunfuric đặc, nóng là:
A. Tính oxi hóa mạnh và tính háo nước
B. Tính axit mạnh
C. Tác dụng với kim loại, giải phóng hidro
D. Không tác dụng với C, P, S.
Câu 6: Cho một lượng Fe tác dụng với dung dịch H2SO4 đặc, nóng, dư thì muối thu được là
A. Fe2(SO4)3.
B. FeSO4.
C. Fe2(SO4)3 và FeSO4.
D. Fe3(SO4)2.
Câu 7: Cho 0,2 mol Cu tan hết trong dung dịch H2SO4 đặc, nóng thu được khí SO2. Thể tích khí thu được (đktc) là
A. 1,12 lít
B. 4,48 lít
C. 2,24 lít
D. 6,72 lít
Câu 8: Các nguyên tố nhóm VIA có cấu hình e ngoài cùng là:
A. ns2
B. ns2np5
C. ns2np3
D. ns2np4
Câu 9: Điều nhận xét nào sau đây không đúng về lưu huỳnh:
A. điều kiện thường: thể rắn
B. có 2 dạng thù hình
C. vừa có tính oxi hóa và khử
D. dễ tan trong nước.
Câu 10: Số oxi hóa của lưu huỳnh trong lưu huỳnh đioxit là
A. -2
B. +4
C. +6
D. 0
Câu 11: Cho 0,2 mol khí SO2 tác dụng với dung dịch chứa 0,3 mol NaOH thu được:
A. 0,2 mol Na2SO3
B. 0,2 mol NaHSO3
C. 0,15 mol Na2SO3
D. Na2SO3 và NaHSO3 đều 0,1 mol
Câu 12: Trong hợp chất, lưu huỳnh có các số oxi hóa thông dụng sau:
A. -1, -2, +4
B. -2, +4, +6
C. 0, +4, +6
D. 0, -2, +6
Câu 13: Khuynh hướng chính của oxi là
A. nhận thêm 2e, có tính khử mạnh
B. nhường 2e, có tính oxi hóa mạnh
C. nhường 2e, có tính khử mạnh
D. nhận thêm 2e, có tính oxi hóa mạnh
Câu 14: Số oxi hóa của lưu huỳnh trong hidrosunfua là
A. -2
B. +4
C. +6
D. 0
Câu 15: Tính chất hóa học cơ bản của hidrosunfua là:
A. vừa có tính oxi hóa, vừa có tính khử.
B. tính khử.
C. tính oxi hóa.
D. Tính bazơ.
Câu 16: Phương pháp chung để nhận biết ion sunfat:
A. Dùng ion Ba2+.
B. Dùng ion Na+.
C. Dùng Cl-.
D. Không nhận biết được.
Câu 17: Tính chất hóa học cơ bản của lưu huỳnh đioxit là:
A. tính bazơ.
B. tính oxi hóa.
C. vừa có tính oxi hóa, vừa có tính khử.
D. tính khử.
Câu 18: Vật bằng Ag để trong không khí ô nhiểm H2S bị xám đen do phản ứng:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O. Vai trò của H2S là
A. chất khử
B. axit
C. chất tự oxi hóa khử
D. chất oxi hóa
Câu 19: Có thể dùng dung dịch nào sau đây để phân biệt SO2 và CO2 ?
A. Ba(OH)2
B. Ca(OH)2
C. Br2
D. NaOH
Câu 20: Ngoài cách nhận biết H2S bằng mùi, có thể dùng dung dịch
A. Al(NO3)3.
B. CaCl2
C. Pb(NO3)2
D. BaCl2
II. PHẦN TỰ LUẬN (3 câu, 5 điểm)
Câu 1 (2điểm): Hoàn thành các phương trình hóa học sau (ghi rõ điều kiện phản ứng, nếu có):
S + O2 → b. H2SO4 + CuO → c. H2SO4 (đặc) + Cu → d. Ba(OH)2 + Na2SO4 →
Câu 2 (1 điểm): Khi khí H2S tham gia phản ứng oxi hóa – khử, người ta có nhận xét: Hidro sunfua chỉ thể hiện tính khử. Hãy giải thích nhận xét trên và dẫn ra một phản ứng hóa học để minh họa.
Câu 3 (2 điểm): Cho 4,8g Mg tác dụng với dung dịch H2SO4 đặc, nóng dư thu được V lít khí SO2 duy nhất (ở đktc).
Tính V.
Sục lượng SO2 thu được ở trên vào 200ml dung dịch NaOH 1M. Hỏi: Muối nào được tạo thành? Tính nồng độ mol muối thu được.
(Cho: Mg = 24; Na = 23; S = 32; O = 16; H = 1)
ĐÁP ÁN
I. PHẦN TRẮC NGHIỆM (20 câu, 5đ)
| 1.A | 2.D | 3.C | 4.C | 5.A | 6.A | 7.B | 8.D | 9.D | 10.B |
| 11.D | 12.B | 13.D | 14.A | 15.B | 16.A | 17.C | 18.B | 19.C | 20.C |
II. PHẦN TỰ LUẬN (3 câu, 5 điểm)
|
Câu |
NỘI DUNG |
|
1 (2điểm) |
a. S + O2 SO2 b. H2SO4 + CuO → CuSO4 + H2O c. 2H2SO4 (đặc) + Cu CuSO4 + SO2 + 2H2O d. Ba(OH)2 + Na2SO4 → BaSO4¯ + 2NaOH |
|
2 (1điểm) |
Do số oxi hóa của S trong H2S là -2 (số oxi hóa nhỏ nhất) nên trong các phản ứng hóa học S-2 chỉ có thể nhận thêm electron → tính khử
|
|
3 (2điểm) |
a. * Pthh: 2H2SO4 (đặc) + Mg MgSO4 + SO2 + 2H2O (1) |
|
b. nNaOH = 0,2.1 = 0,2 mol
- Pthh: SO2 + NaOH→NaHSO3 (2)
|