Phương trình Arrhenius - Khái niệm, công thức và bài tập về Phương trình Arrhenius
Tổng hợp khái niệm, công thức và bài tập về Phương trình Arrhenius chi tiết giúp các em vận dụng giải các bài tập Hóa học
1. Phương trình Arrhenius là gì?
Phương trình Arrhenius là một công thức cho sự phụ thuộc nhiệt độ của tốc độ phản ứng. Phương trình được Svante Arrhenius đề xuất vào năm 1889, dựa trên công trình của nhà hóa học người Hà Lan Jacobus Henricus van 't Hoff, người đã lưu ý vào năm 1884 rằng phương trình của Van' t Hoff cho sự phụ thuộc nhiệt độ của hằng số cân bằng cho thấy công thức của cả hai phản ứng thuận và ngược.
Phương trình Arrhenius giúp chúng ta hiểu rõ hơn về cách nhiệt độ ảnh hưởng đến tốc độ của các phản ứng hóa học. Khi nhiệt độ tăng lên, phản ứng thường diễn ra nhanh hơn do năng lượng hoạt hóa giảm và phân phối năng lượng của các phân tử trong hệ thống thay đổi.
Thông qua việc áp dụng phương trình Arrhenius, giúp chúng ta dự đoán và điều chỉnh tốc độ của các phản ứng hóa học trong các ứng dụng thực tế như sản xuất công nghiệp, phát triển dược phẩm, và các quá trình sinh học.
2. Công thức của phương trình Arrhenius
Có hai dạng phổ biến của phương trình Arrhenius. Mà một trong những bạn sử dụng phụ thuộc vào việc bạn có một năng lượng kích hoạt về năng lượng cho mỗi nốt ruồi (như trong hóa học) hoặc năng lượng cho mỗi phân tử (phổ biến hơn trong vật lý). Các phương trình cơ bản giống nhau, nhưng các đơn vị thì khác nhau.
Phương trình Arrhenius như được sử dụng trong hóa học thường được công bố theo công thức:
k = Ae -Ea / (RT)
Ở đây:
- k là hằng số tốc độ
- A là một hệ số mũ là hằng số cho một phản ứng hóa học nhất định, liên quan đến tần số va chạm của các hạt
- E a là năng lượng kích hoạt của phản ứng (thường được tính bằng Joules trên mol hoặc J / mol)
- R là hằng số khí phổ dụng
- T là nhiệt độ tuyệt đối (tính bằng Kelvin )
Trong vật lý, hình thức phổ biến hơn của phương trình là:
k = Ae -Ea / (K B T)
Ở đây:
- k, A và T giống như trước
- Ea là năng lượng kích hoạt của phản ứng hóa học ở Joules
- kB là hằng số Boltzmann
Trong cả hai dạng của phương trình, các đơn vị A đều giống với các đơn vị của hằng số tốc độ. Các đơn vị thay đổi theo thứ tự phản ứng. Trong một phản ứng thứ tự đầu tiên , A có đơn vị của mỗi giây (s-1 ), do đó, nó cũng có thể được gọi là yếu tố tần số. Hằng số k là số va chạm giữa các hạt tạo ra phản ứng mỗi giây, trong khi A là số va chạm trên giây (có thể hoặc không thể xảy ra phản ứng) theo hướng thích hợp cho phản ứng xảy ra.
Đối với hầu hết các phép tính, thay đổi nhiệt độ đủ nhỏ để năng lượng kích hoạt không phụ thuộc vào nhiệt độ. Nói cách khác, thường không cần phải biết năng lượng kích hoạt để so sánh ảnh hưởng của nhiệt độ đến tốc độ phản ứng. Điều này làm cho toán học đơn giản hơn nhiều.
Từ việc kiểm tra phương trình, rõ ràng là tốc độ phản ứng hóa học có thể tăng lên bằng cách tăng nhiệt độ phản ứng hoặc bằng cách giảm năng lượng kích hoạt của nó. Đây là lý do tại sao chất xúc tác tăng tốc độ phản ứng!
3. Bài tập phương trình Arrhenius
Bài 1: Tìm hệ số tốc độ ở 273 K để phân hủy nitơ dioxide, có phản ứng:
2NO2(g) → 2NO (g) + O2(g)
Biết năng lượng kích hoạt của phản ứng là 111 kJ / mol, hệ số tốc độ là 1,0 x 10-10 S-1và giá trị của R là 8,14 x 10-3 kJ mol-1K-1.
Giải:
Trước hết, cần giả sử A và E một không thay đổi đáng kể theo nhiệt độ. (Một sai lệch nhỏ có thể được đề cập trong phân tích lỗi, nếu bạn được yêu cầu xác định nguồn lỗi.) Với các giả định này, có thể tính giá trị của A ở 300 K. Khi bạn có A, bạn có thể cắm nó vào phương trình để giải cho k ở nhiệt độ 273 K.
Bắt đầu bằng cách thiết lập tính toán ban đầu:
k = Ae-Ea/ RT
1,0 x 10-10 S-1 = Ae(-11 kJ / mol) / (8,14 x 10-3 kJ mol-1K-1) (300K)
Sử dụng máy tính khoa học của bạn để giải quyết A và sau đó cắm giá trị cho nhiệt độ mới. Để kiểm tra công việc của bạn, hãy chú ý nhiệt độ giảm gần 20 độ, vì vậy phản ứng chỉ nên nhanh hơn khoảng một phần tư (giảm khoảng một nửa cho mỗi 10 độ)
Bài 2: Cho hằng số tốc độ của một phản ứng là 11 M-1.s-1 tại nhiệt độ 345K và hằng số thực nghiệm Arrhenius là 20 M-1.s-1. Tính năng lượng hoạt hóa của phản ứng trên.
Giải:
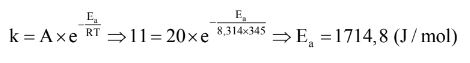
Bài 3: Tìm hằng số tốc độ phản ứng k ở 273K của phản ứng phân hủy
N2O5 (g) → N2O4 (g) + 1⁄2 O2 (g)
Biết rằng ở 300K, năng lượng hoạt hóa là 111 kJ/mol và hằng số tốc độ phản ứng là 10-10s-1.
Giải:
Đặt k’ = 10-10s-1 ứng với T’ = 300K, T = 273K.
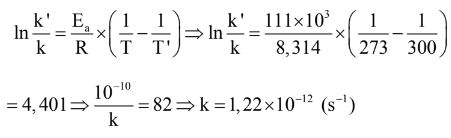
Bài 4: Một phản ứng đơn giản xảy ra ở nhiệt độ 100°C, trong điều kiện có xúc tác và không có xúc tác, năng lượng hoạt hóa của phản ứng lần lượt là Ea1 = 25 kJ/mol và Ea2 = 50 kJ/mol. So sánh tốc độ phản ứng trong 2 điều kiện.
Giải:

