Sơ đồ tư duy Hóa 10 Chương 1: Cấu tạo nguyên tử (Kết nối tri thức)
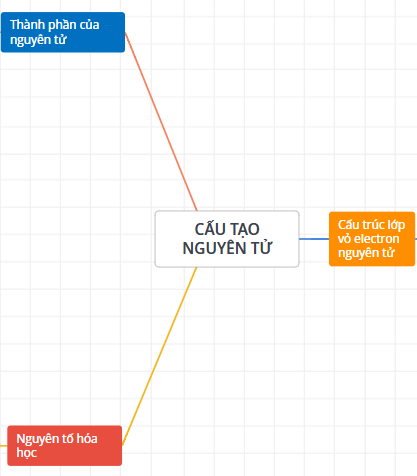
1/ Sơ đồ tư duy Hóa 10 chương 1 Cấu tạo nguyên tử gồm 3 phần chính: Thành phần nguyên tử, Nguyên tố hóa học, Cấu trúc lớp vỏ electron nguyên tử
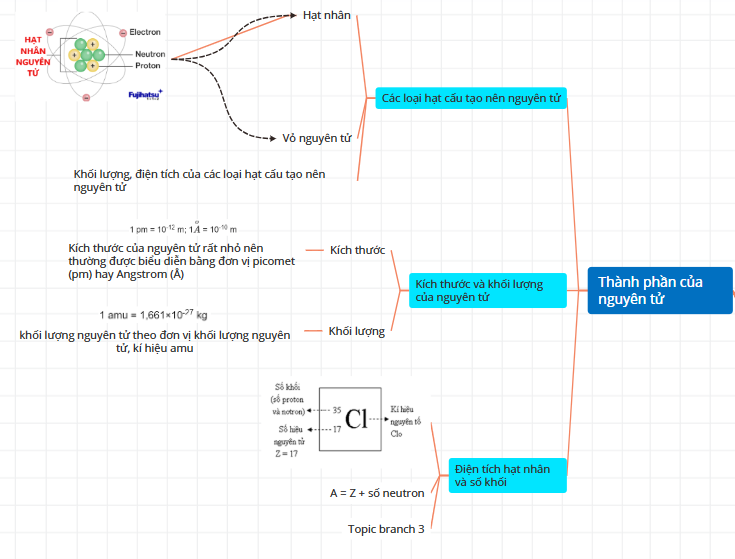
2/ Thành phần nguyên tử
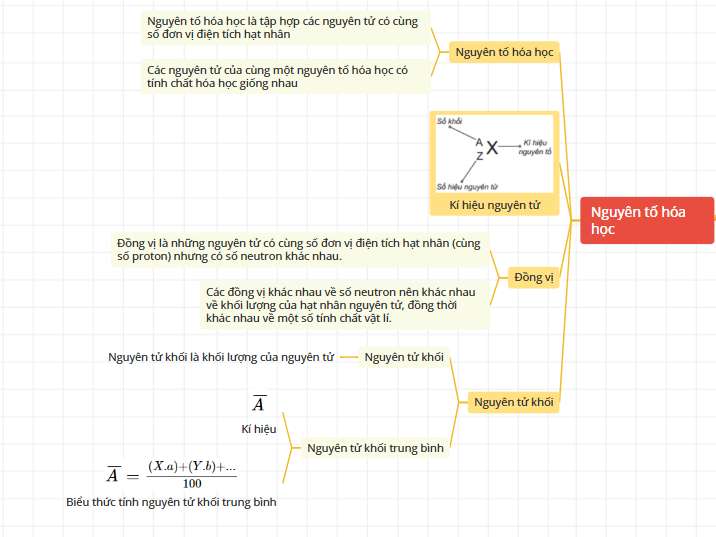
3/ Nguyên tố hóa học
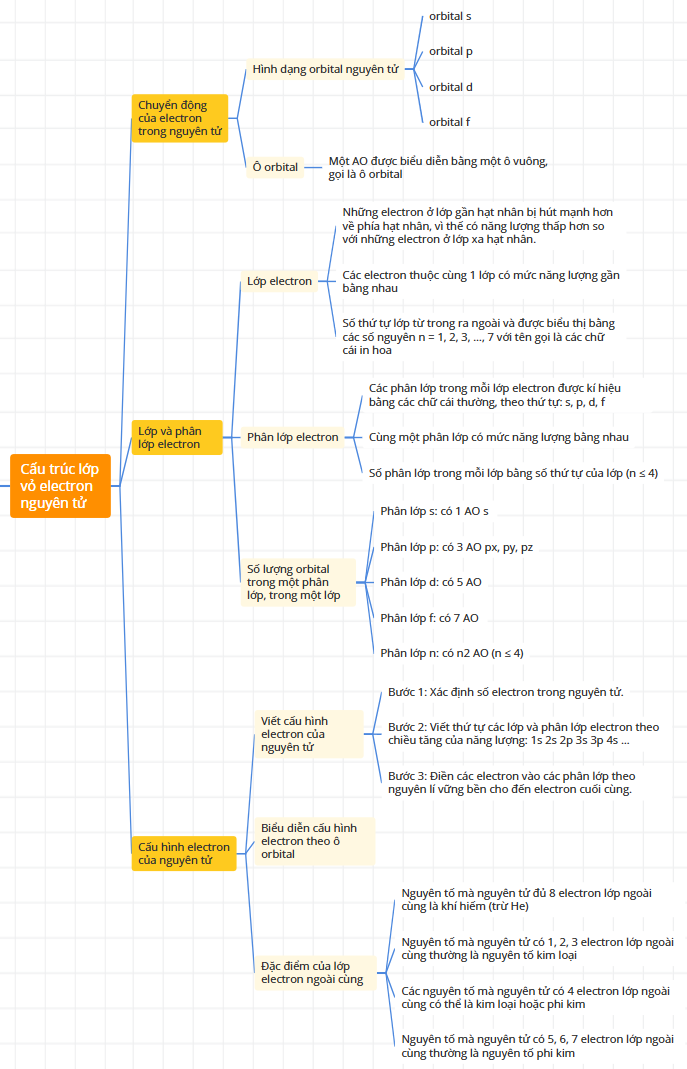
4/ Cấu trúc lớp vỏ nguyên tử
Xuất bản : 17/06/2021 - Cập nhật :
04/12/2024
Câu hỏi thường gặp
Tìm Kiếm Bài Viết
