Lý thuyết Hóa học 11 Chân trời sáng tạo Bài 1: Khái niệm về cân bằng hóa học
Tóm tắt Lý thuyết Hóa học 11 Chân trời sáng tạo Bài 1 Khái niệm về cân bằng hóa học ngắn gọn, chi tiết. Tổng hợp lý thuyết Hóa học 11 Bài 1 chương trình Sách mới.
Bài 1: Khái niệm về cân bằng hóa học
1. Phản ứng một chiều, phản ứng thuận nghịch và cân bằng hóa học.
a. Tìm hiểu khái niệm phản ứng một chiều
- Phản ứng một chiều: Là phản ứng chỉ xảy ra theo chiều từ chất tham gia tạo thành sản phẩm mà sản phẩm không thể tác dụng với nhau lại chất ban đầu.
- Kí hiệu: (→) dùng để chỉ chiều phản ứng.
b. Tìm hiểu khái niệm phản ứng thuận nghịch
- Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều trái ngược nhau.
- Kí hiệu: (⇌). Chiều từ trái sang phải là chiều thuận, chiều từ phải sang trái chiều nghịch
c. Tìm hiểu khái niệm trạng thái cân bằng của phản ứng thuận nghịch
- Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Ví dụ:
H2(g) + I2(g) ⇌ 2HI(g)
2SO2(g) + O2(g) ⇌ 2SO3(g)
2. Hằng số cân bằng của phản ứng thuận nghịch
Tìm hiểu hằng số cân bằng của phản ứng thuận nghịch
- Nếu phản ứng thuận nghịch ở dạng:

- Khi ở trạng thái cân bằng ta có:
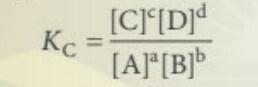
+ [A], [B], [C], [D] là nồng độ mol các chất ở trạng thái cân bằng
+ a, b, c, d hệ số tỉ lượng
+ Hằng số cân bằng Kc phụ thuộc vào nhiệt độ
3. Sự chuyển dịch cân bằng hóa học
Thí nghiệm nghiên cứu ảnh hưởng của nhiệt độ đến tới sự chuyển dịch cân bằng hóa học
- Nghiên cứu sự chuyển dịch cân bằng của phản ứng: 2NO2(g) ⇌ N2O2(g) hoặc thủy phân sodium acetate.
=> Sự chuyển dịch cân bằng hóa học là sự chuyển dịch từ trang thái cân bằng này sang trạng thái cân bằng khác.
4. Các yếu tố ảnh hưởng đến cân bằng hóa học
a. Tìm hiểu ảnh hưởng của nhiệt độ đến cân bằng hóa học
- Khi tăng nhiệt độ: Cân bằng chuyển dịch theo chiều phản ứng thu nhiệt (hay chiều làm giảm tác động)
- Khi nhiệt độ giảm: Cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt
b. Tìm hiểu ảnh hưởng của áp suất đến cân bằng hóa học
- Khi hệ đang ở trạng thái cân bằng thì tăng hoặc giảm áp suất chung của hệ, cân bằng bao giờ cũng chuyển dịch theo chiều làm giảm tác động của việc tăng hoặc giảm áp suất đó.
- Khi hệ số tỉ lượng của hai về bằng nhau không làm chuyển dịch cân bằng của hệ.
c. Tìm hiểu ảnh hưởng của nồng độ đến cân bằng hóa học
- Khi tăng hoặc giảm nồng độ một chất trong cân bằng thì cân bằng bao giờ cũng chuyển dịch theo chiều làm giảm tác động của việc tăng hoặc giảm nồng độ của chất đó.
Ví dụ:
C(r)+CO2 (k)⇌2CO(k)
>>> Xem toàn bộ: Lý thuyết Hóa 11 Chân trời sáng tạo
-------------------------------------------
Trên đây Toploigiai đã cùng các bạn tổng hợp Lý thuyết Hóa học 11 Chân trời sáng tạo Bài 1 theo chương trình Sách mới. Mời các bạn click vào trang chủ Toploigiai để tham khảo và chuẩn bị bài cho năm học mới Lớp 11 nhé. Chúc các bạn học tốt.
