Lý thuyết Hóa 10 Bài 38. Cân bằng hóa học
Lý thuyết Hóa 10 Bài 38. Cân bằng hóa học
I. PHẢN ỨNG MỘT CHIỀU, PHẢN ỨNG THUẬN NGHỊCH VÀ CÂN BẰNG HÓA HỌC
1. Phản ứng một chiều
- Là phản ứng chỉ xảy ra một chiều từ trái sang phải.
![]()
- Trong phương trình hóa học của phản ứng một chiều, người ta dùng một mũi tên chỉ chiều phản ứng.
2. Phản ứng thuận nghịch
- Là những phản ứng xảy ra theo hai chiều trái ngược nhau trong cùng điều kiện.
![]()
- Trong phương trình hóa học của phản ứng thuận nghịch, người ta dùng hai mũi tên ngược chiều nhau.
3. Cân bằng hóa học
* Xét phản ứng thuận nghịch sau:
![]()
- Sự biến đổi của tốc độ phản ứng thuận vtvt và phản ứng nghịch vnvn được xác định theo đồ thị sau:
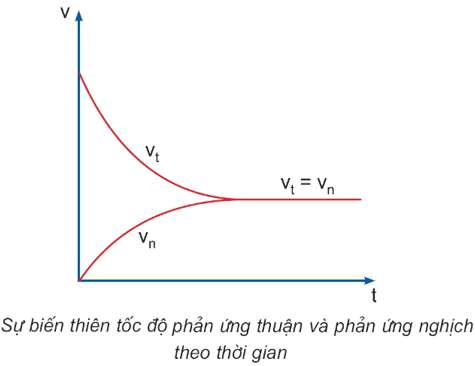
- Khi vt=vn thì phản ứng đạt trạng thái cân bằng và được gọi là cân bằng hóa học.
* Kết luận:
- Định nghĩa: Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
- Cân bằng hóa học là một cân bằng động.
- Ở trạng thái cân bằng, trong hệ luôn luôn có mặt các chất phản ứng và các chất sản phẩm.
II. SỰ CHUYỂN DỊCH CÂN BẰNG HÓA HỌC
1. Thí nghiệm
- Lắp bộ dụng cụ gồm 2 ống nghiệm có nhánh (a) và (b), được nối với nhau bằng một ống nhựa mềm, có khóa K như hình:
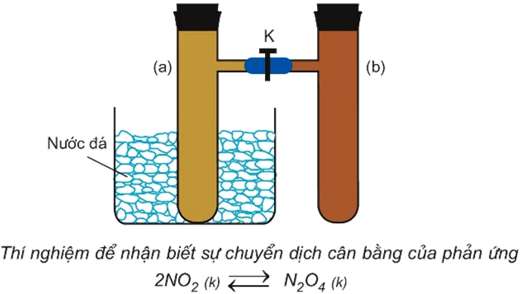
- Nạp đầy khí NO2 vào cả hai ống nghiệm ở nhiệt độ thường. Nút kín cả hai ống, xét cân bằng:
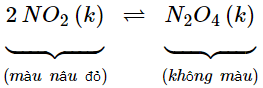
- Màu của hỗn hợp khí trong cân bằng ở cả hai ống là như nhau.
- Đóng khóa K, ngăn khí ở 2 ống khuếch tán vào nhau.
- Ngâm ống (a) vào nước đá, cân bằng chuyển dịch theo chiều làm giảm NO2 và tăng N2O4 nên màu của ống nghiệm (a) nhạt hơn lúc ban đầu.
⟹ Hiện tượng đó được gọi là sự chuyển dịch cân bằng hóa học.
2. Định nghĩa
- Sự chuyển dịch cân bằng hóa học là sự di chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác do tác động của các yếu tố từ bên ngoài lên cân bằng.
III. CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN CÂN BẰNG HÓA HỌC
1. Ảnh hưởng của nồng độ
* Xét cân bằng sau:
![]()
- Khi tăng CO2 thì cân bằng chuyển dịch theo chiều thuận (chiều làm giảm CO2).
- Khi giảm CO2 thì cân bằng chuyển dịch theo chiều nghịch (chiều làm tăng CO2).
* Kết luận:
- Khi tăng hoặc giảm nồng độ một chất trong cân bằng thì cân bằng bao giờ cũng chuyển dịch theo chiều làm giảm tác động của việc tăng hoặc giảm nồng độ của chất đó.
- Lưu ý: Chất rắn không làm ảnh hưởng đến cân bằng của hệ.
2. Ảnh hưởng của áp suất
* Xét cân bằng sau:
![]()
- Khi tăng áp suất thì cân bằng chuyển dịch theo chiều làm giảm áp suất.
- Khi giảm áp suất thì cân bằng chuyển dịch theo chiều làm tăng áp suất.
* Kết luận:
- Khi tăng hoặc giảm áp suất chung của hệ cân bằng thì cân bằng bao giờ cũng chuyển dịch theo chiều làm giảm tác động của việc tăng hoặc giảm áp suất đó.
- Lưu ý: Khi số mol khí ở 2 vế bằng nhau (hoặc phản ứng không có chất khí) thì áp suất không ảnh hưởng đến cân bằng.
Thí dụ:
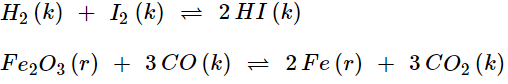
3. Ảnh hưởng của nhiệt độ
* Phản ứng thu nhiệt và phản ứng tỏa nhiệt:
- Phản ứng thu nhiệt là phản ứng lấy thêm năng lượng để tạo sản phẩm. Kí hiệu ΔH > 0.
- Phản ứng tỏa nhiệt là phản ứng mất bớt năng lượng. Kí hiệu ΔH < 0.
* Ví dụ: Xét phản ứng sau:
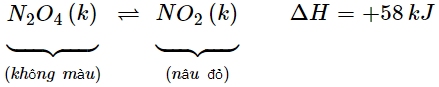
- Nhận xét:
+ Phản ứng thuận thu nhiệt vì ΔH = +58 kJ > 0
+ Phản ứng nghịch tỏa nhiệt vì ΔH = −58 kJ < 0
⟹ Ảnh hưởng của nhiệt độ đến cân bằng hóa học: Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng thu nhiệt (giảm tác động tăng nhiệt độ). Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt (giảm tác động giảm nhiệt độ).
* Kết luận:
- Nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
4. Vai trò của chất xúc tác
- Chất xúc tác không ảnh hưởng đến cân bằng hóa học.
- Vai trò chất xúc tác là làm tăng tốc độ phản ứng thuận và phản ứng nghịch với số lần bằng nhau.
- Khi chưa cân bằng thì chất xúc tác làm cho cân bằng thiết lập nhanh hơn.
IV. Ý NGHĨA CỦA TỐC ĐỘ PHẢN ỨNG VÀ CÂN BẰNG HÓA HỌC TRONG SẢN XUẤT HÓA HỌC
Xem xét một số thí dụ sau để thấy ý nghĩa của tốc độ phản ứng và cân bằng hóa học trong sản xuất hóa học:
* Thí dụ 1:
![]()
- Ở nhiệt độ thường, phản ứng xảy ra chậm. Để tăng tốc độ phản ứng phải dùng chất xúc tác và tăng nhiệt độ. Nhưng đây là phản ứng tỏa nhiệt, nên khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch làm giảm hiệu suất phản ứng. Để hạn chế tác dụng này, người ta dùng một lượng dư không khí, nghĩa là tăng nồng độ oxi, làm cho cân bằng chuyển dịch theo chiều thuận.
* Thí dụ 2:
![]()
- Ở nhiệt độ thường, tốc độ phản ứng xảy ra rất chậm; nhưng ở nhiệt độ cao, cân bằng chuyển dịch theo chiều nghịch; do đó, phản ứng này phải được thực hiện ở nhiệt độ thích hợp, áp suất cao và dùng chất xúc tác.
