Lý thuyết Hóa 10 Bài 30. Lưu huỳnh
Lý thuyết Hóa 10 Bài 30. Lưu huỳnh
I. VỊ TRÍ, CẤU HÌNH ELECTRON NGUYÊN TỬ
- Vị trí: Ô thứ 16, chu kì 3, nhóm VIA
- Kí hiệu: ![]()
- Cấu hình e: 1s2 2s2 2p6 3s2 3p4
- Độ âm điện: 2,58
II. TÍNH CHẤT VẬT LÍ
1. Hai dạng thù hình của lưu huỳnh
- Có 2 dạng thù hình:
+ Lưu huỳnh tà phương: Sα
+ Lưu huỳnh đơn tà: Sβ
- Chúng khác nhau về cấu tạo tinh thể và một số tính chất vật lí nhưng tính chất hóa học giống nhau.
- Hai dạng thù hình có thể biến đổi qua lại với nhau tùy theo điều kiện nhiệt độ.
2. Ảnh hưởng của nhiệt độ đến tính chất vật lí
- Ở t0< 113oC, Sα và Sβ là chất rắn màu vàng, phân tử có 8 nguyên tử liên kết cộng hóa trị với nhau tạo mạch vòng.
- Ở t0= 1190C, Sα và Sβ nóng chảy thành chất lỏng màu vàng, rất linh động.
- Ở t0= 1870C, lưu huỳnh lỏng trở nên quánh nhớt, có màu nâu đỏ.
- Ở t0= 4450C, lưu huỳnh sôi.
III. TÍNH CHẤT HÓA HỌC
- Nguyên tử S có 6e lớp ngoài cùng, trong đó có 2e độc thân.
- Khi tham gia phản ứng hóa học, số oxi hóa của lưu huỳnh có thể giảm hoặc tăng: −2; 0; +4; +6.
⟹ Lưu huỳnh có tính oxi hóa và tính khử.
1. Tính oxi hóa
- Khi lưu huỳnh tác dụng với kim loại hoặc hiđro, số oxi hóa của lưu huỳnh từ 00 giảm xuống −2
![]()
a) Tác dụng với kim loại
- Lưu huỳnh tác dụng với nhiều kim loại tạo muối sunfua.
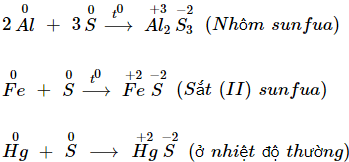
b) Tác dụng với hiđro
- Lưu huỳnh tác dụng với khí hiđro tạo thành khí hiđro sunfua.
![]()
2. Tính khử
- Khi lưu huỳnh phản ứng với phi kim hoạt động mạnh hơn, số oxi hóa của lưu huỳnh từ 00 tăng lên +4 hoặc +6.
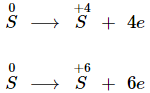
a) Tác dụng với phi kim
- Lưu huỳnh phản ứng với phi kim ở nhiệt độ thích hợp.
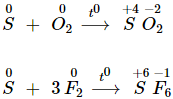
b) Tác dụng với chất oxi hóa mạnh (H2SO4,HNO3,...)
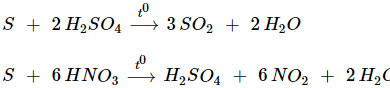
IV. ỨNG DỤNG CỦA LƯU HUỲNH
- 90% lưu huỳnh dùng điều chế H2SO4.
- 10% lưu huỳnh dùng lưu hóa cao su, sản xuất chất tẩy trắng bột giấy, diêm, chất dẻo ebonit, dược phẩm, phẩm nhuộm, thuốc trừ sâu, chất diệt nấm trong nông nghiệp…
V. TRẠNG THÁI TỰ NHIÊN VÀ SẢN XUẤT LƯU HUỲNH
1. Trạng thái tự nhiên
- Lưu huỳnh tồn tại ở dạng đơn chất, dạng mỏ lưu huỳnh.
- Lưu huỳnh cũng tồn tại ở dạng hợp chất là các muối sunfat, muối sunfua…
2. Sản xuất lưu huỳnh
a) Phương pháp vật lí
- Dùng khai thác lưu huỳnh dưới dạng tự do trong lòng đất.
- Dùng hệ thống nén nước siêu nóng (1700C) vào mỏ lưu huỳnh để đẩy lưu huỳnh nóng chảy lên mặt đất.
b) Phương pháp hóa học
- Đốt H2S trong điều kiện thiếu không khí:
2H2S + O2 ⟶ 2S + 2H2O
- Dùng H2S khử SO2:
2H2S + SO2 ⟶ 3S + 2H2O
Xem thêm Giải Hóa 10: Bài 30. Lưu huỳnh
