Lý thuyết Hóa 10 Bài 29. Oxi - ozon
Lý thuyết Hóa 10 Bài 29. Oxi - ozon
A – OXI
I. VỊ TRÍ VÀ CẤU TẠO
- Oxi thuộc nhóm VIA, chu kì 2 của bảng tuần hoàn các nguyên tố hóa học.
- Kí hiệu hóa học: O
- Số hiệu: 8
- Cấu hình electron: 1s2 2s2 2p4
⟶ Có 2e độc thân và 6e lớp ngoài cùng
- Khối lượng nguyên tử: 16
- Công thức phân tử: O2
- Công thức cấu tạo: O=O
- Khối lượng phân tử: 32
II. TÍNH CHẤT VẬT LÍ
- Oxi là chất khí không màu, không mùi và không vị, hơi nặng hơn không khí
![]()
- Dưới áp suất của khí quyển, oxi hóa lỏng ở −183oC.
- Khí oxi ít tan trong nước.
III. TÍNH CHẤT HÓA HỌC
- Nguyên tử oxi có 6e6e lớp ngoài cùng, dễ nhận thêm 2e (để đạt cấu hình electron của khí hiếm).
![]()
- Độ âm điện của O = 3,44 < F= 3,98
⟶ Oxi là nguyên tố phi kim hoạt động mạnh, có tính oxi hóa mạnh.
- Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hóa −2.
1. Tác dụng với kim loại
- Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt…) tạo oxit kim loại.
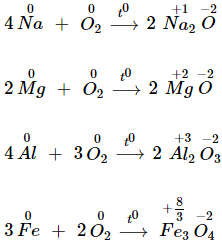
2. Tác dụng với hiđro
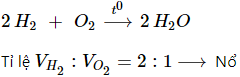
3. Tác dụng với phi kim
- Oxi tác dụng với hầu hết phi kim (trừ halogen) tạo oxit phi kim.
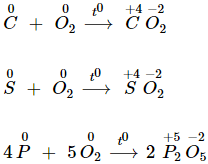
4. Tác dụng với hợp chất
- Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
- Ở nhiệt độ cao, nhiều hợp chất cháy trong khí oxi tạo oxit.
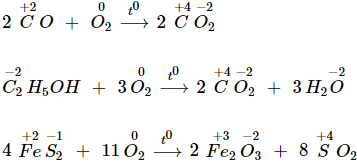
⟹ Oxi là chất oxi hóa (Các quá trình oxi hóa đều tỏa nhiệt).
IV. ỨNG DỤNG
- Oxi có vai trò quyết định đến sự sống của con người và động vật. Mỗi người, mỗi ngày cần 20−30m3 không khí để thở.
- Oxi phục vụ cho các ngành công nghiệp hóa chất, luyện gang thép, y học, vũ trụ…
V. ĐIỀU CHẾ
1. Điều chế oxi trong phòng thí nghiệm
- Phân hủy những hợp chất giàu oxi và ít bền đối với nhiệt như KMnO4 , KClO3...
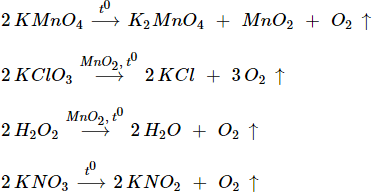
2. Sản xuất oxi trong công nghiệp
a) Từ không khí
- Không khí được loại bỏ hết hơi nước, bụi, khí CO2. Sau đó được hóa lỏng và chưng cất phân đoạn, thu được khí oxi ở =−183oC.
b) Từ nước
- Điện phân nước (có hòa tan H2SO4 hay NaOH để tăng tính dẫn điện của nước) thu được khí oxi ở cực dương và khí hiđro ở cực âm.
![]()
B – OZON (O3)
I. TÍNH CHẤT
- Ozon là một dạng thù hình của oxi.
1. Tính chất vật lí
- O3 là chất khí, mùi đặc trưng, màu xanh nhạt.
- Khí ozon hóa lỏng ở nhiệt độ −112oC, có màu xanh đậm.
- Ozon tan trong nước nhiều hơn O2.
2. Tính chất hóa học
- Ozon có tính oxi hóa rất mạnh (mạnh hơn oxi). Ozon oxi hóa hầu hết các kim loại (trừ Au và Pt), nhiều phi kim và nhiều hợp chất vô cơ, hữu cơ.
- Thí dụ, ở nhiệt độ thường, oxi không oxi hóa được bạc, nhưng ozon oxi hóa bạc thành bạc oxit:
2Ag + O3 ⟶ Ag2O +O2
- Hay oxi không oxi hóa được ion I− trong dung dịch, nhưng ozon oxi hóa ion I− thành I2:
![]()
II. OZON TRONG TỰ NHIÊN
- Trong khí quyển, ozon hình thành từ oxi do ảnh hưởng của tia cực tím hoặc sự phóng điện trong cơn giông. Trên mặt đất, ozon được sinh ra do sự oxi hóa một số chất hữu cơ.
![]()
- Ozon tập trung ở lớp khí quyển cách mặt đất 20 − 30km.
- Tầng ozon hấp thụ tia tử ngoại từ tầng cao của không khí, bảo vệ con người và các sinh vật trên mặt đất tránh được tác hại của tia này.
III. ỨNG DỤNG
- Không khí chứa một lượng rất nhỏ ozon có tác dụng làm không khí trong lành (nhưng lượng lớn sẽ gây hại cho con người).
- Dựa vào tính oxi hóa, ozon được ứng dụng để khử trùng y tế, chữa sâu răng, sát trùng nước sinh hoạt, tẩy trắng trong công nghiệp…
Xem thêm Giải Hóa 10: Bài 29. Oxi - Ozon
