Bài 44. Luyện tập chương 6
Giải SBT Hóa 8: Bài 44. Luyện tập chương 6
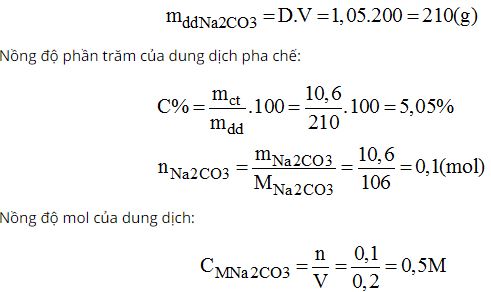
Bài 44.1 trang 60 sách bài tập Hóa 8:
Cân 10,6g muối Na2CO3 cho vào cốc chia độ. Rót vào cốc khoảng vài chục ml nước cất, khuấy cho muối tan hết. Sau đó rót thêm nước vào cốc cho đủ 200ml. Ta được dung dịch Na2CO3 có khối lượng riêng là 1,05g/ml. Hãy tính nồng độ phần trăm và nồng độ mol của dung dịch vừa pha chế.
Lời giải:
Bài 44.2 trang 60 sách bài tập Hóa 8:
Có CuSO4 và nước cất. Hãy tính toán và trình bay cách pha chế để có được những sản phẩm sau:
a) 50ml dung dịch CuSO4 có nồng độ 1mol/l
b) 50g dung dịch CuSO4 có nồng độ 10%.
Lời giải:
a) Pha chế 50ml dung dịch CuSO4 1M
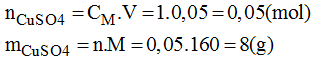
* Cách pha chế:
Cân 8g CuSO4 cho vào bình. Cho thêm từ từ nước cất vào bình và khuấy đều cho muối tan đến khi đủ 50ml. Ta được 50ml dung dịch CuSO4 có nồng độ 1M
b) Pha chế 50g dung dịch CuSO4 10%
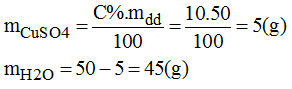
* Cách pha chế: cân lâ 5g CuSO4 cho vào cốc. Rót từ từ 45g nước cất, khuấy đều cho CuSO4 tan hết, ta được 50g dung dịch CuSO4 10%.
Bài 44.3 trang 60 sách bài tập Hóa 8:
Bảng dưới đây cho biết độ tan của một muối trong nước thay đổi theo nhiệt độ:

a) Vẽ đồ thị biểu diễn độ tan của muối trong nước (trục tung biểu thị khối lượng chất tan, trục hoành biểu thị nhiệt độ).
b) Căn cứ vào đồ thị, hãy ước lượng độ tan của muối ở 25oC và 55o
c) Tính số gam muối tan trong:
200g nước để có dung dịch bão hòa ở nhiệt độ 20oC.
2kg nước để có dung dịch bão hòa ở nhiệt độ 50oC.
Lời giải:
a) Đồ thị biểu diễn độ tan của muối trong nước.
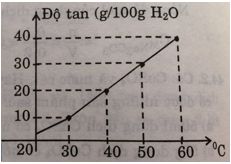
b) Độ tan của muối:
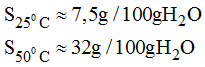
c) * Ở 20oC thì độ tan của muối là 5g
Vậy trong 200g nước muối tan có khối lượng:
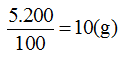
* Ở 50oC:
Độ tan của muối là 28g
Vậy trong 2kg nước muối tan có khối lượng:
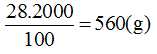
Bài 44.4 trang 60 sách bài tập Hóa 8:
Người ta pha chế một dung dịch NaCl ở 20oC bằng cách hòa tan 23,5g NaCl trong 75g nước. Căn cứ vào độ tan của NaCl trong nước
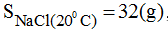
, hãy cho biết dung dịch NaCl đã pha chế là bão hòa hay chưa bão hòa? Nếu dung dịch NaCl là chưa bão hòa, làm thế nào để có được dung dịch NaCl bão hòa ở 20oC?
Lời giải:
Ở 20oC thì 75g nước hòa tan tối đa muối NaCl có khối lượng:
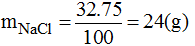
Vậy dung dịch NaCl đã pha chế là chưa bão hòa. Để dung dịch NaCl bão hòa ở nhiệt độ này, ta cần cho thêm vào dung dịch đã pha chế một lượng NaCl là: 24 - 23,5 = 0,5(g)
Bài 44.5 trang 61 sách bài tập Hóa 8:
Hãy tính toán và trình bày cách pha chế 0,5lit dung dịch H2SO4 có nồng độ 1mol/l từ H2SO4 có nồng độ 98%, khối lượng riêng là 1,84g/ml.
Lời giải:
* Số mol của H2SO4 cần để pha chế 500ml dung dịch H2SO4 1M:
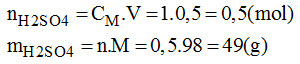
* Khối lượng H2SO4 98% có chứa 49g H2SO4:
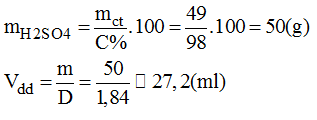
* Cách pha chế: Đổ khoảng 400ml nước cất vào cốc có chia độ có dung tích khoảng 1lit. Rót từ từ 27,2ml H2SO4 98% vào cốc khuấy đều. Sau đó thêm dần dần nước cất vào cốc cho đủ 500ml. ta pha chế được 500ml dung dịch H2SO4 1M.
Bài 44.6* trang 61 sách bài tập Hóa 8:
A là dung dịch H2SO4 có nồng độ 0,2M. B là dung dịch H2SO4 có nồng độ 0,5M.
a) Nếu trộn A và B theo tỉ lệ thể tích VA : VB = 2:3 được dung dịch C. Hãy xác định nồng độ mol của dung dịch C.
b) Phải trộn A và B theo tỉ lệ nào về thể tích để được dung dịch H2SO4 có nồng độ 0,3M.
Lời giải:
a) Ta có: VA:VB = 2:3
Số mol H2SO4 có trong 2V dung dịch A:
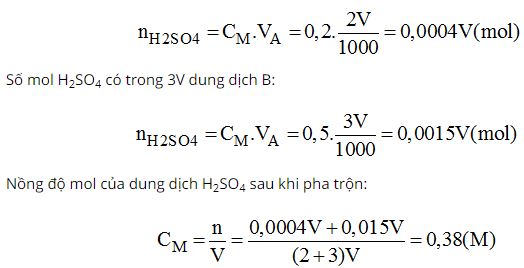
Vậy nồng độ mol của dung dịch C là 0,38M.
b) Pha chế dung dịch H2SO4 0,3M.
Gọi x(ml) là thể tích của dung dịch axit A.
y(ml) là thể tích của dung dịch B.
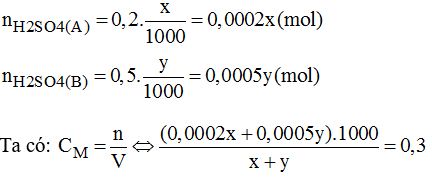
→ x = 2y. Vậy nêu y = 1 và x = 2.
Vậy ta phải trộn 2 thể tích dung dịch axit A với 1 thể tích dung dịch axit B, ta sẽ được dung dịch H2SO4 có CM = 0,3M.
Bài 44.7* trang 61 sách bài tập Hóa 8:
Có 200g dung dịch NaOH 5% (dung dịch A).
a) Cần phải trộn thêm vào dung dịch A bao nhiêu gam dung dịch NaOH 10% để được dung dịch NaOH 8%?
b) Cần hòa tan bao nhiêu gam NaOH vào dung dịch A để có dung dịch A để có dung dịch NaOH 8%?
c) Làm bay hơi nước dung dịch A, người ta cũng thu được dung dịch NaOH 8%. Tính khối lượng nước đã bay hơi.
Lời giải:
a) Gọi x(g) là khối lượng dung dịch NaOH 10% cần dùng:
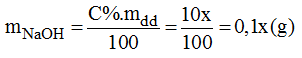

Vậy phải trộn thêm 6,52g NaOH vào dung dịch A để được dung dịch A để được dung dịch NaOH 8%.
c) Gọi x(g) là khối lượng của nước bay hơi khỏi dung dịch để có dung dịch NaOH 8%.
Ta có công thức:
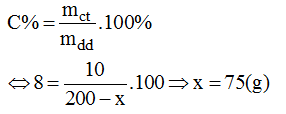
Vậy cho 75g nước bay hơi ra khỏi 200g dung dịch NaOH ban đầu, ta có: 200 – 75 = 125(g) dung dịch NaOH 8%.
