Bài 30. Ankađien
Bài 30. Ankađien
Bài 30.1 trang 46 SBT Hóa 11:
Cho isopren (2-metylbuta-1,3-đien) phản ứng cộng với brom theo tỉ lệ 1:1 về số mol. Số đồng phân cấu tạo có cùng công thức phân tử C5H8Br2 tối đa có thể thu được là
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án: C.
Bài 30.2 trang 46 SBT Hóa 11:
Trong các chất dưới đây, chất nào được gọi tên là đivinyl ?
A. CH2= C = CH - CH3
B. CH2= CH - CH = CH2
C. CH2= CH - CH2- CH = CH2
D. CH2= CH - CH = CH - CH3
Lời giải:
Đáp án: B.
Bài 30.3 trang 47 SBT Hóa 11:
Cho butan-1,3-ddien phản ứng cộng với brom theo tỉ lệ 1:1 (về số mol) ở -80oC, sản phẩm chính thu được là
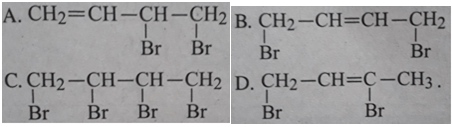
Lời giải:
Đáp án: A.
Bài 30.4 trang 47 SBT Hóa 11:
Các nhận xét sau đây đúng hay sai ?
1. Các chất có công thức CnH2n-2đều là ankađien.
2. Các ankađien đều có công thức CnH2n-2
3. Các ankađien đều có 2 liên kết đôi.
4. Các chất có 2 liên kết đôi đều là ankađien.
Lời giải:
1 - Sai;
2 - Đúng;
3 - Đúng;
4 - Sai.
Bài 30.5 trang 47 SBT Hóa 11:
Viết công thức cấu tạo của:
1. 2,3-đimetylbuta-1,3-đien;
2. 3-metylpenta-1,4-đien.
Lời giải:
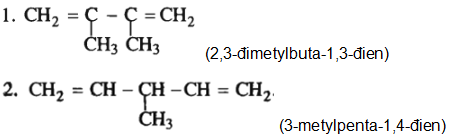
Bài 30.6 trang 47 SBT Hóa 11:
Chất A là một ankađien liên hợp có mạch cacbon phân nhánh. Để đốt cháy hoàn toàn 3,4 g A cần dùng vừa hết 7,84 lít O2 lấy ở đktc.
Hãy xác định công thức phân tử, công thức cấu tạo và tên của chất A.
Lời giải:
![]()
Theo phương trình:
Cứ (14n - 2) g ankađien tác dụng với ![]() mol O2.
mol O2.
Theo đầu bài: Cứ 3,4 g ankađien tác dụng với 0,35 mol O2.
![]()
Công thức phân tử: C5H8
Công thức cấu tạo: 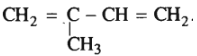 (2-metylbutan-1,3-đien (isopren))
(2-metylbutan-1,3-đien (isopren))
Bài 30.7 trang 47 SBT Hóa 11:
Hỗn hợp khí A chứa một ankan và một ankađien. Để đốt cháy hoàn toàn 6,72 lít A phải dùng vừa hết 28 lít O2 (các thể tích lấy ở đktc). Dẫn sản phẩm cháy qua bình thứ nhất đựng H2SO4 đặc, sau đó qua bình thứ hai đựng dung dịch NaOH (lấy dư) thì khối lượng bình thứ nhất tăng p gam và bình thứ hai tăng 3,52 g.
1. Xác định công thức phân tử và phần trăm theo thể tích của từng chất trong hỗn hợp A.
2. Tính giá trị p.
Lời giải:
Giả sử trong 6,72 lít A có x mol CnH2n+2 y moi CmH2m-2.
![]()
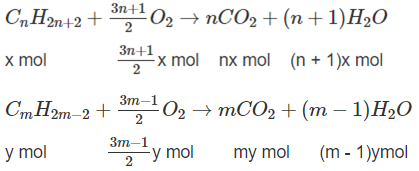
Số mol O2: 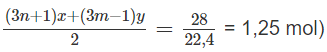
⇒(3n + 1)x + (3m − 1)y = 2,5 (2)
Số mol CO2: nx + my = 0,8 (mol)
⇒ (3n + 1)x + (3m - 1)y = 2,5 (3)
Từ (2) và (3) tìm được x - y = 0,1 ;
Kết hợp với X + y = 0,3, ta có: x = 0,2 và y = 0,1 Thay các giá trị tìm được vào (3) ta có
0,2n + 0,1m = 0,8
⇒ 2n + m = 8.
Nếu n = 1 thì m = 6: Loại, vì C6H10 không phải là chất khí ở đktc. Nếu n = 2 thì m = 4. Công thức hai chất là C2H6 và C4H6.
Nếu n = 3 thì m = 2: Loại vì m > 3.
Trả lời: Hỗn hợp A chứa (66,67%) và C4H6 (33,33%)
Số mol H2O = (n + 1)x + (m - 1)y = 0,9 (mol).
2. Khối lượng nước: p = 0,9.18 = 16,2 (g).